 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
称取一元弱酸HA试样1.000g,溶于60.0mL水中,用0.2500mol·L-1。NaOH溶液滴定。已知中和HA至50%时,溶液的pH=5.00
称取一元弱酸HA试样1.000g,溶于60.0mL水中,用0.2500mol·L-1。NaOH溶液滴定。已知中和HA至50%时,溶液的pH=5.00;当滴定至化学计量点时,pH=9.00。计算试样中HA的质量分数。(假设HA的摩尔质量为82.00g·mol-1。)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
称取一元弱酸HA试样1.000g,溶于60.0mL水中,用0.2500mol·L-1。NaOH溶液滴定。已知中和HA至50%时,溶液的pH=5.00;当滴定至化学计量点时,pH=9.00。计算试样中HA的质量分数。(假设HA的摩尔质量为82.00g·mol-1。)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“称取一元弱酸HA试样1.000g,溶于60.0mL水中,用0…”相关的问题
更多“称取一元弱酸HA试样1.000g,溶于60.0mL水中,用0…”相关的问题
称取含NaH2PO4和Na2HPO4及中性杂质的试样1.000g,溶于适量水后,以百里酚酞作指示剂,用0.1000mol·L-1NaOH标准溶液滴定至刚好变色,耗去NaOH溶液20.00mL;继续于同一体系中加入溴甲酚绿指示剂(变色范围为pH=3.8~5.4),改用0.1000mol·L-1HCl标准溶液滴定至终点,耗去HCl溶液30.00mL,求试样中NaH2PO4、Na2HPO4的质量分数。[已知M(NaH2PO4)=120.0g·mol-1;M(Na2HPO4)=142.0g·mol-1]
称取仅含弱酸盐NaA和NaB的Na2CO3试样0.6125g,加水溶解后,以甲基橙为指示剂,用浓度为0.2000mol/L HCl标准溶液滴定,甲基橙变色时,消耗HCl标准溶液32.72mL;上述等量样品加水溶解后,若以酚酞为指示剂,用0.1000mol/L HCl标准溶液滴定,消耗25.34mL。(1)写出有关反应方程式;(2)各组分的质量分数是多少?(已知:弱酸HA的pKa=7.0,弱酸HB的pKa=1,MNa2CO3=105.99,MNaA=182.03,MNaB=132.0)
某一元弱酸HA的浓度为0.010mol·L-1,在常温下测得其pH为4.0。求该一元弱酸的解离平衡常数和解离度。
将0.050dm3,浓度为0.10mol·dm-3一元弱酸HA溶液与0.020dm3,0.10mol·dm-3KOH溶液混合后稀释至0.10dm3,测得溶液pH=5.25,求HA的解离常数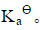 。
。
今有一元弱酸HA在0.10mol·L-1溶液中有2.0%解离。试计算:
(1)HA的Ka;
(2)在0.050mol·L-1溶液中的解离度;
(3)溶液浓度为多少时有1.0%的解离?
今有原电池:
(—)Pt|H2(100kPa)|HA(0.500mol·L-1)||Cl-(1.00mol·L-1)|AgCl|Ag()
在298.15K时测得电池电动势为0.568V,试计算一元弱酸HA的酸度常数。
称取含BaCl2试样0.5000g,溶于水后加25.00mL 0.05000mol/L KIO3将Ba2+沉淀为Ba(IO3)2,滤去沉淀,洗涤,加入过量KI于滤液中并酸化,滴定析出的I2,消耗0.1000mol/L的Na2S2O3标准溶液21.18mL。写出有关反应方程式,计算BaCl2的百分含量?(MBaCl2=208.27)
准确量取30.00 mL弱酸HA,加水稀释至100.00 mL,在电池:(—)SHE|HA || SCE()中,以0.100 0 mol·L-1NaOH标准溶液滴定之。25℃时,当弱酸HA被中和一半时,电池电动势为0.524 V,化学计量点时,电池电动势为0.749 V。求:(1)弱酸HA的电离常数Kα值。(2)原弱酸HA溶液的浓度?(已知饱和甘汞电极的电极电位为0.244 V)
取某一元弱酸(HA)纯品1.250g,溶成50mL水溶液。用NaOH溶液(0.090mol·dm-3)滴定至化学计量点,消耗41.20mL。在滴定过程中,当滴定剂加到8.24mL时,溶液的pH为4.30。计算:
某合金钢中含有Mn和Cr,称取1.000g钢样,溶解后稀释至50.00mL,将其中的Cr氧化至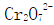 ,Mn氧化至
,Mn氧化至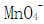 ,然后在440nm和545nm波长时用1.0cm比色皿测得吸光度分别为0.204和0.860。已知在440nm波长时,Mn和Cr的摩尔吸收系数分别为
,然后在440nm和545nm波长时用1.0cm比色皿测得吸光度分别为0.204和0.860。已知在440nm波长时,Mn和Cr的摩尔吸收系数分别为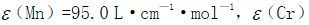
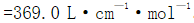 。在545nm波长时,Mn和Cr的摩尔吸收系数分别为
。在545nm波长时,Mn和Cr的摩尔吸收系数分别为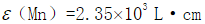
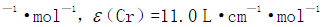 。求钢样中Mn、Cr的百分含量。[M(Mn)=54.94g·mol-1,M(Cr)=52.00g·mol-1]
。求钢样中Mn、Cr的百分含量。[M(Mn)=54.94g·mol-1,M(Cr)=52.00g·mol-1]