 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
某一化学反应,在298 K和大气压力下进行,当反应进度为1 mol时,放热 40.0kJ。若使反应通过可
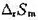 ;(2)当该反应不通过可逆电池完成时,求环境的熵变和隔离系统的总熵变,隔离系统的总熵变值说明了什么问题;(3)计算系统可能做的最大功的值。
;(2)当该反应不通过可逆电池完成时,求环境的熵变和隔离系统的总熵变,隔离系统的总熵变值说明了什么问题;(3)计算系统可能做的最大功的值。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
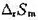 ;(2)当该反应不通过可逆电池完成时,求环境的熵变和隔离系统的总熵变,隔离系统的总熵变值说明了什么问题;(3)计算系统可能做的最大功的值。
;(2)当该反应不通过可逆电池完成时,求环境的熵变和隔离系统的总熵变,隔离系统的总熵变值说明了什么问题;(3)计算系统可能做的最大功的值。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“某一化学反应,在298 K和大气压力下进行,当反应进度为1 …”相关的问题
更多“某一化学反应,在298 K和大气压力下进行,当反应进度为1 …”相关的问题
已知Na2CO3(s)和H2O()可以生成如下三种水合物: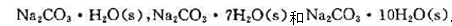 。试求:(1)在大气压力下,与Na2CO3水溶液和冰平衡共存的水合盐的最大值;(2)在298 K时,与水蒸气平衡共存的水合盐的最大值。
。试求:(1)在大气压力下,与Na2CO3水溶液和冰平衡共存的水合盐的最大值;(2)在298 K时,与水蒸气平衡共存的水合盐的最大值。
度相同,则吸热4.0kJ。(1)计算反应进度为1mol时的熵变△rSm;(2)当该反应不通过可逆电池完成时,求环境的熵变和隔离系统的总熵变,隔离系统的总熵变值说明了什么问题;(3)计算系统可能做的最大功的值。
A.难以判断
B.Kθ>1
C.Kθ=1
D.Kθ<1
已知298 K时,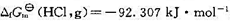 ,反应H2(g) +Cl2(g)→2HCl(g)在催化剂的作用下,可大大加快反应的速率,则此反应的
,反应H2(g) +Cl2(g)→2HCl(g)在催化剂的作用下,可大大加快反应的速率,则此反应的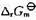 (298 K)为()
(298 K)为()
A. -92. 307 kJ·mol-1
B. -228.4kJ·mol-1
C. -184. 614 kJ·mol-1
D.不能确定
银可能受H2S气体的腐蚀而发生下列反应

已知在298 K和100 kPa压力下,Ag2S(s)和H2S(g)的标准生成Gibbs自由能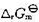 分别为- 40.26kJ·mol-1和-33.02 kJ·mol-1。试问在298 K和100 kPa压力下,
分别为- 40.26kJ·mol-1和-33.02 kJ·mol-1。试问在298 K和100 kPa压力下,
(1)在H2S(g)和H2(g)的等体积的混合气体中,Ag是否会被腐蚀生成Ag2S(s)?
(2)在H2S(g)和H2(g)的混合气体中,H2S(g)的摩尔分数低于多少时便不至于使Ag被腐蚀?
在温度为298K、100kPa压力下,已知C(金刚石)和C(石墨)的摩尔熵、摩尔燃烧焓和密度分别为
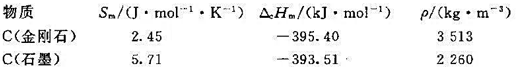
(1)在298 K及100 kPa下,试求C(石墨)→C(金刚石)的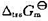 ;
;
(2)在298K及100kPa下,哪个晶体更为稳定?
(3)增加压力能否使不稳定的晶体向稳定晶体转化?如有可能,至少要加多大的压力,才能实现这种转化?
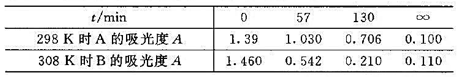
某溶液的反应A+B→P,当A和B的起始浓度为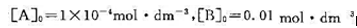 时,实验测得不同温度下吸光度随时间的变化如下表:
时,实验测得不同温度下吸光度随时间的变化如下表:
当固定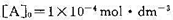 ,改变[B]o时,实验测得在298 K时,t1/2随[B]0的变化如下表:
,改变[B]o时,实验测得在298 K时,t1/2随[B]0的变化如下表:

设速率方程为r=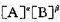 ,试计算α、β、速率常数k和实验活化能
,试计算α、β、速率常数k和实验活化能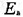 。
。
某基元反应A(g)+ B(g)→P(g),设在298 K时的速率常数kp(298 K)=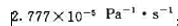 308 K时,
308 K时,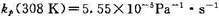 .若A(g)和B(g)的原子半径和摩尔质量分别为
.若A(g)和B(g)的原子半径和摩尔质量分别为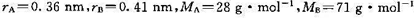 .试求在298 K时,(1)该反应的概率因子P;(2)反应的活化焓
.试求在298 K时,(1)该反应的概率因子P;(2)反应的活化焓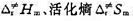 和活化Gibbs自由能
和活化Gibbs自由能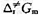 .
.
某一气相反应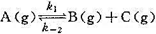 ,已知在298 K时,k1=0.21s-1,k-2=5×10-9Pa-1·s-1,当温度由298 K升到310 K时,k和k-2的值均增加1倍,试求:
,已知在298 K时,k1=0.21s-1,k-2=5×10-9Pa-1·s-1,当温度由298 K升到310 K时,k和k-2的值均增加1倍,试求:
(1)298K时的反应平衡常数Kp;
(2)正、逆反应的实验活化能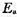 ;
;
(3)298K时反应的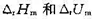 ;
;
(4)在298K时,A的起始压力为100kPa,若使总压力达到152kPa,所需的时间。
298 K时,反应N2O4(g)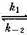 2NO2(g)的速率常数
2NO2(g)的速率常数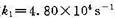 ,已知N2O4(g)和NO2(g)的标准摩尔生成Gibbs自由能分别为
,已知N2O4(g)和NO2(g)的标准摩尔生成Gibbs自由能分别为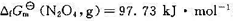 和
和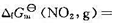 51.25 kJ·mol-1。请计算:(1)在298 K时,N2O4(g)的初始压力为100 kPa,NO2(g)的平衡分压;(2)该反应的弛豫时间r。
51.25 kJ·mol-1。请计算:(1)在298 K时,N2O4(g)的初始压力为100 kPa,NO2(g)的平衡分压;(2)该反应的弛豫时间r。
298 K时测得SrSO,饱和水溶液的电导率r(溶液)=1.482×10-2S·m-1,该温度时水的电导率k(水)=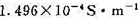 ,试计算该条件下SrSO4在水中的饱和溶液的浓度。
,试计算该条件下SrSO4在水中的饱和溶液的浓度。