 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
假设Mg2+与EDTA的浓度皆为10-2mol·dm-3,(1) 在pH=6.0时,镁与EDTA配合物的条件稳定常数是多少(不考虑羟基配
假设Mg2+与EDTA的浓度皆为10-2mol·dm-3,(1) 在pH=6.0时,镁与EDTA配合物的条件稳定常数是多少(不考虑羟基配位效应)?在此条件下能否用EDTA标准溶液滴定Mg2+?(2) 求其允许滴定的最小pH。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
假设Mg2+与EDTA的浓度皆为10-2mol·dm-3,(1) 在pH=6.0时,镁与EDTA配合物的条件稳定常数是多少(不考虑羟基配位效应)?在此条件下能否用EDTA标准溶液滴定Mg2+?(2) 求其允许滴定的最小pH。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“假设Mg2+与EDTA的浓度皆为10-2mol·dm-3,(…”相关的问题
更多“假设Mg2+与EDTA的浓度皆为10-2mol·dm-3,(…”相关的问题
pH=10.0的NH3-NH4Cl缓冲溶液中,游离NH3的浓度为0.10mol·L-1。若同时含有浓度皆为0.010mol·L-1的Ag+和Zn2+,以同浓度的EDTA滴定Zn2+,Ag+有无干扰?(lgKZnY=16.50,lgKAgY=7.32;pH=10.0时,lgαY(H)=0.45;Zn2+与NH3络合的lgβ1~lgβ4分别为2.27、4.61、7.01、9.06;Ag+与NH3络合的lgβ1=3.40,lgβ2=7.10)
混合等体积

在Al3+、Zn2+、Mg2+共存的酸性溶液中欲测定Mg2+,试指出以下分析步骤中的错误之处(简述理由),并改正。
“吸取一定量试液于锥形瓶中,加入10%KCN1mL,以NaOH溶液调试液的pH约为10,加入1:3三乙醇胺15mL,再加入0.2%二甲酚橙指示剂2~3滴,以EDTA标准溶液滴至溶液由红紫变亮黄色为终点。”
在图5-2所示的方框图中,假设A=-103,kf=10-2;晶体三极管参数为gm=154mS;集电极电阻RC=2kΩ。如果基本放大器A的输入电阻为无限大,试求电压增益Avf=vo/vi。

已知Fe3+与EDTA配合物的lgKFeY=25.1,若在pH=6.0时以0.010mol/L EDTA滴定同浓度的Fe3+,考虑αY(H)和αFe(OH)后,lg
某溶液中反应A+B→C,开始时反应物A与B的物质的量相等,没有产物C。1小时后A的转化率为75%,问2小时后A尚有多少未反应?假设:
(1)对A为一缴,对B为零级;
(2)对A、B皆为1级。
在Al3+、Zn2+、Mg2+共存的酸性溶液中欲测定Mg2+,试指出以下分析步骤中的错误之处(简述理由),并改正。
吸取一定量试液于锥形瓶中,加入10%KCN 1mL,以NaOH溶液调节溶液的pH约等于10,加入1:3三乙醇胺15mL,再加入0.2%二甲酚橙指示剂2~3滴,以EDTA标准溶液滴至溶液由红紫变亮黄色为终点。
用0.01060mol/L EDTA标准溶液滴定水中钙和镁的含量,取100.0mL水样,以铬黑T为指示剂,在pH=10时滴定,消耗EDTA 31.30mL。另取一份100.0mL水样,加NaOH使呈强碱性,使Mg2+成Mg(OH)2沉淀,用钙指示剂指示终点,继续用EDTA滴定,消耗19.20mL。计算:
(1)水的总硬度(以CaCO3mg/L表示);
(2)水中钙和镁的含量(以CaCO3mg/L和MgCO3mg/L表示)。
计算pH=5.0时,0.10mol/L H2C2O4溶液中的浓度。(已知:H2C2O4的Ka1=5.9×10-2,Ka2=6.4×10-5)
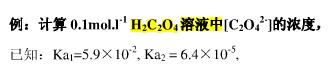
计算pH=5.0时,0.10mol/L H2C2O4溶液中[H+]、[HC2O4-]、[C2O42-]的浓度。(已知:H2C2O4的Ka1=5.9×10-2,Ka2=6.4×10-5)
用0.020mol·L-1EDTA溶液滴定浓度为0.020mol·L-1La3+和0.050mol·L-1Mg2+混合溶液中的La3+,设△pLa'=0.2,欲要求Et≤0.3%时,则适宜酸度范由为多少?若指示剂不与Mg2+显色,则适宜酸度范围又为多少?若以二甲酚橙作指示剂。αY(H)=0.1αY((Mg)时,滴定La3+的终点误差为多少?已知lgK'LaIn在pH=4.5、5.0、5.5、6.0时分别为4.0、4.5、5.0、5.6,且Mg2+与二甲酚橙不显色;La(OH)3的Ksp=10-18.8。