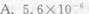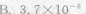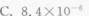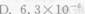题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
浓度为25.5μg/50mL的Cu2+溶液,用双环乙酮草酰二腙光度法进行测定,于波长600nm处用2cm吸收池进行测量,测得T=
浓度为25.5μg/50mL的Cu2+溶液,用双环乙酮草酰二腙光度法进行测定,于波长600nm处用2cm吸收池进行测量,测得T=50.5%,求摩尔吸光系数ε、桑德尔灵敏度S。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
浓度为25.5μg/50mL的Cu2+溶液,用双环乙酮草酰二腙光度法进行测定,于波长600nm处用2cm吸收池进行测量,测得T=50.5%,求摩尔吸光系数ε、桑德尔灵敏度S。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“浓度为25.5μg/50mL的Cu2+溶液,用双环乙酮草酰二…”相关的问题
更多“浓度为25.5μg/50mL的Cu2+溶液,用双环乙酮草酰二…”相关的问题
浓度为25.5μg·(50mL)-1的Cu2+溶液,用双环己酮草酰二腙光度法进行测定,于波长600nm处用2cm吸收池进行测量,测得T=50.5%,求摩尔吸光系数ε、桑德尔灵敏度S。
度为0.325,在另一份试液中加入浓度为50.0mg/L镉标准溶液300μL,测得吸光度为0.670。计算试液中镉的质量浓度(g/L)。
纯蔗糖溶液的比旋光率[α]=6.65°/[cm·(g/cm3)],今有不知纯度的蔗糖溶液,浓度为20%(即每100cm3中有20g蔗糖)溶液的厚度为20cm,对一线偏振光振动面产生25°的旋转。求这种蔗糖溶液的纯度(即纯糖占蔗糖的百分比)。
通氮气10min,然后扫描电位记录极谱波高,记录纸上测得波高50格,另取5.00mL试液,加1.00mL(0.50mg·mL-1)标准Cu2+溶液,然后按上述同样方法分析,得波高为80格。解释各操作步骤的作用;计算样品中铜的含量。
用EDTA溶液(2.0×10-2mol/L)滴定相同浓度的Cu2+,若溶液pH=10,游离氨浓度为0.20mol/L,

欲从镀银废液中回收金属银,废液中AgNO3的浓度为1×10-6mol·kg-1,还含少量的Cu2+。今以银为阴极、石墨为阳极电解回收银,要求银的回收率达99%。试问阴极电位应控制在什么范围之内?Cu2+离子浓度应低于多少才不致使铜和银同时析出?(设所有的活度系数均为1)。
在pH=3.0,Cu2+浓度为0.20mol/L的缓冲溶液中,以铂作为阳极沉积铜,此时O2在铂电极上生成,且分压为1.00atm,电池的电阻是2.80Ω,温度是25℃,铜极为阴极。求:(1)铜开始析出的理论分解电压是多少;(2)当电流为0.15A时,iR降是多少;(3)若氧的过电位是0.85V,那么分解电压是多少;(4)若Cu2+浓度为0.001mol/L,其他条件都不变,其分解电压是多少。
在0.10mol/L HCl溶液中通入H2S气体至饱和(饱和H2S溶液浓度为0.10mol/L),计算溶液中残留S2-浓度。
取某一元弱酸(HA)纯品1.250g,溶成50mL水溶液。用NaOH溶液(0.090mol·dm-3)滴定至化学计量点,消耗41.20mL。在滴定过程中,当滴定剂加到8.24mL时,溶液的pH为4.30。计算:
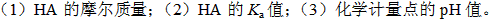
50ml、0.1mol/L的某一元己弱酸HA溶液与20ml、0.10mol/L的KOH溶液混合,并加水稀释至100ml,测得该溶液的pH=5.25。此一元弱酸的电离常数为()。