 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
一个可逆电动势为1.07V的原电池,在恒温槽中恒温至293K,当此电池短路(即直接发生化学反应,不做电功)时有1000
一个可逆电动势为1.07V的原电池,在恒温槽中恒温至293K,当此电池短路(即直接发生化学反应,不做电功)时有1000C的电荷量通过。假定电池中发生的反应与可逆放电时的反应相同,试求以此电池和恒温槽都看做系统时总的熵变。如果要分别求算恒温槽和电池的熵变,还需何种数据?
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
一个可逆电动势为1.07V的原电池,在恒温槽中恒温至293K,当此电池短路(即直接发生化学反应,不做电功)时有1000C的电荷量通过。假定电池中发生的反应与可逆放电时的反应相同,试求以此电池和恒温槽都看做系统时总的熵变。如果要分别求算恒温槽和电池的熵变,还需何种数据?
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“一个可逆电动势为1.07V的原电池,在恒温槽中恒温至293K…”相关的问题
更多“一个可逆电动势为1.07V的原电池,在恒温槽中恒温至293K…”相关的问题
A.电极极化就是电极的电极电位偏离了由能斯特方程计算出来的平衡电位
B.原电池就是最原始的Cu-Zn电极组成的丹尼尔电池
C.电池的电动势为负值时就是原电池,否则就是电解池
D.可逆电极就是可以进行逆向电化学反应的电极
A.1.39V
B.0.62V
C.0.92V
D.1.07V
有一个原电池由两个氢电极组成,其中有一个标准氢电极,为得到最大电动势,另一个电极浸入的酸性溶液[设p(H2)=100kPa]应为( )。
(A) 0.1mol·dm-3HCl (B) 0.1mol·dm-3HAc
(C) 0.1mol·dm-3H3PO4
(D) 0.1mol·dm-3HAc+0.1mol·dm-3NaAc
今有原电池:
(—)Pt|H2(100kPa)|HA(0.500mol·L-1)||Cl-(1.00mol·L-1)|AgCl|Ag()
在298.15K时测得电池电动势为0.568V,试计算一元弱酸HA的酸度常数。
将下列反应组成原电池(温度为298.15K):2Fe3++Cu====2Fe2++Cu2+
(1)计算原电池的标准电动势;(2)写出其电池符号;(3)指出正极、负极,并写出电极反应;(4)当Cu2+的浓度升到10mol·L-1时,原电池的电动势为多少?
将反应Ag(s)→Ag-Au(合金,a(Ag)=0.1)设计成原电池图式为______,25℃时该电池的电动势E=______。
某学生为测定CuS的溶度积常数,设计如下原电池:正极为铜片,在0.1mol·dm-3Cu2+的溶液中,再通入H2S气体使之达到饱和;负极为标准锌电极。测得电池电动势为0.670V。已知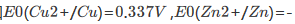 0.763V,H2S的
0.763V,H2S的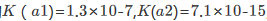 。试求CuS的溶度积常数。
。试求CuS的溶度积常数。
A.0.1 mol.dm-3HCl
B.0.1 mol.dm-3HAe+0.1 mol.dm-3NaAc
C.0.1 mol.dm-3HAc
D.0.1 mol.dm-3H2PO4
今有原电池如下:
(-)Pt,H2(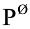 )|HA(0.5mol·L-1)‖NaCl(1mol·L-1)|AgCl(s),Ag()经测定知其电动势为0.568V,试计算一元酸HA的电离常数。[
)|HA(0.5mol·L-1)‖NaCl(1mol·L-1)|AgCl(s),Ag()经测定知其电动势为0.568V,试计算一元酸HA的电离常数。[ (AgCl/Ag)=0.2223V]
(AgCl/Ag)=0.2223V]
A.电动势的大小表明了电池反应的趋势
B.电动势的大小表征了原电池反应所做的最大非体积功
C.标准电动势小于零时,电池反应不能进行
D.标准平衡常数为1时,该电池反应达平衡
E.某些情况下电动势的值与电极电势值相同
由标准锌电极和标准铜电极组成原电池: (-)Zn丨ZnSO4(1 mol.dm-3)丨CuSO4(1 mol.dm-3)丨Cu() (1)改为下列条件对原电池的电动势有何影响? (a)增加ZnSO4溶液的浓度;(b)在ZnSO4溶液中加入过量的NaOH;(e)增加铜片的电极表面积;(d)在CuSO4溶液中加入H2S。 (2)当铜锌原电池工作半小时以后,原电池的电动势是否会发生变化,为什么?