 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知298.15K时,电极反应:V,Ag2C2O4的Ksp为3.5×10-11,求电极反应Ag2C2O2+2e-2Ag+C2O2-4的标准电极电势。
已知298.15K时,电极反应: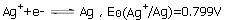 ,Ag2C2O4的Ksp为3.5×10-11,求电极反应Ag2C2O2+2e-
,Ag2C2O4的Ksp为3.5×10-11,求电极反应Ag2C2O2+2e- 2Ag+C2O2-4的标准电极电势
2Ag+C2O2-4的标准电极电势 。
。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知298.15K时,电极反应: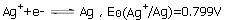 ,Ag2C2O4的Ksp为3.5×10-11,求电极反应Ag2C2O2+2e-
,Ag2C2O4的Ksp为3.5×10-11,求电极反应Ag2C2O2+2e- 2Ag+C2O2-4的标准电极电势
2Ag+C2O2-4的标准电极电势 。
。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“已知298.15K时,电极反应:V,Ag2C2O4的Ksp为…”相关的问题
更多“已知298.15K时,电极反应:V,Ag2C2O4的Ksp为…”相关的问题
已知298.15K时, ,
, ,标准态时:(1)写出原电池符号(应自发进行);(2)写出电极反应及电池反应;(3)计算原电池的
,标准态时:(1)写出原电池符号(应自发进行);(2)写出电极反应及电池反应;(3)计算原电池的 ;(4)计算电池反应的
;(4)计算电池反应的 ;(5)求AgI的Ksp。
;(5)求AgI的Ksp。
10.已知

的标准电极电势以及当
将下列反应组成原电池(温度为298.15K):2Fe3++Cu====2Fe2++Cu2+
(1)计算原电池的标准电动势;(2)写出其电池符号;(3)指出正极、负极,并写出电极反应;(4)当Cu2+的浓度升到10mol·L-1时,原电池的电动势为多少?
已知:
(
H
3
AsO
4
/ H
3
AsO
3
)
=+0.560V
,
(
I
2
/ I
-
)
=+0.5355V
,
F
=96485C
·
mol
-1
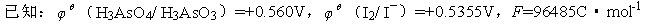
在298.15K时,有下列反应
H3AsO4+2I-+2H+====H3AsO3+I2+H2O

用Pt阴极和Ag阳极做库仑滴定测定HCl溶液的浓度时,在两电极上分别生成H2和AgCl。
(1)假如10.00mL酸被电解,在银库仑计上析出Ag的质量为0.2158g,试问酸的浓度是多少(mol·L-1)?
(2)如果滴定是在恒电流下进行,为了在10min内使反应完全,该用多大的电流?
已知电池(-)Cu|Cu2+(0.1mol·dm-3)||Ag+(0.01mol·dm-3)|Ag(),

准确量取30.00 mL弱酸HA,加水稀释至100.00 mL,在电池:(—)SHE|HA || SCE()中,以0.100 0 mol·L-1NaOH标准溶液滴定之。25℃时,当弱酸HA被中和一半时,电池电动势为0.524 V,化学计量点时,电池电动势为0.749 V。求:(1)弱酸HA的电离常数Kα值。(2)原弱酸HA溶液的浓度?(已知饱和甘汞电极的电极电位为0.244 V)
已知Eθ(MnO-4/Mn2+)=1.51V,Eθ(Cl2/Cl-)=1.36V,若将此两电对组成原电池,请写出:
(1)该电池的电池符号;
(2)写出正负电极的电极反应和电池反应以及电池标准电动势;
(3)计算电池反应在25℃时和Kθ;
(4)当[H+] = 1.0×10-2mol•L-1,而其他离子浓度均为1.0 mol•L-1,= 100 kPa时的电池电动势.
8.在298.15K时,有下列反应
H3AsO4+2I-+2H+====H3AsO3+I2+H2O
(1) 计算该反应组成的原电池的标准电动势。
(2) 计算该反应的标准摩尔吉布斯自由能变并指出该反应能否自发进行。
(3) 若溶液的的pH=7,而c(H3AsO4)=c(H3AsO3)=c(I-)=1mol·dm-3此反应的△rGm是多少?此时反应进行方向?
已知放大电路中,3个MOS管的3个电极的电位如下表所示,其开启电压(夹断电压)也在表中。分析这3个管子的类型及其工作状态。
| MOS管 | UGS(th)或UGS(off) | UG/V | US/V | UD/V | 管 型 | 工作状态 |
| V1 | -4 | 0 | 5 | -5 | ||
| V2 | 4 | 3 | -2 | -1.5 | ||
| V3 | -3 | 0 | 0 | 10 |
4.已知电极反应ClO-3+6H++6e====Cl-+3H2O的∆rGθm=-839.6kJ·mol-1,则E(ClO3-/Cl-)值为( )。
(A) 1.45V (B) 0.73V (C) 2.90V (D) -1.45V