 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
在298K时H2O(l)的标准摩尔生成焓为-285.83kJ/mol,已知在298K至373K的温度范围内H2(g)、O2(g)及H2O(l)的Cp,m
在298K时H2O(l)的标准摩尔生成焓为-285.83kJ/mol,已知在298K至373K的温度范围内H2(g)、O2(g)及H2O(l)的Cp,m分别为28.824M(K·mol)、29.355J/(K.mol)及75.291J/(K·mol)。求373K时H2O(l)的标准摩尔生成焓。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案


 更多“在298K时H2O(l)的标准摩尔生成焓为-285.83kJ…”相关的问题
更多“在298K时H2O(l)的标准摩尔生成焓为-285.83kJ…”相关的问题
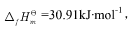 ,标准摩尔生成Gibbs自由能
,标准摩尔生成Gibbs自由能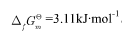 。设不随温度而改变,试计算:
。设不随温度而改变,试计算:
















