 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
用氯离子选择性电极和饱和甘汞电极测定咸番茄汁中氯化物含量时,在100.00 mL番茄汁中测得电动势为
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“用氯离子选择性电极和饱和甘汞电极测定咸番茄汁中氯化物含量时,…”相关的问题
更多“用氯离子选择性电极和饱和甘汞电极测定咸番茄汁中氯化物含量时,…”相关的问题
pH玻璃电极与饱和甘汞电极组成如下电池:玻璃电极|H+(x)‖饱和甘汞电极。测定pH为4.01的邻苯二甲酸氢钾缓冲溶液时,其电池电动势为0.211V。而测定两个未知溶液时,其电池电动势分别为0.435V和0.0186V,试计算两种未知溶液的pH(25℃)。
25℃时,在烧杯中准确加入100.0mL水样,将甘汞电极(作正极)与Ca2+选择性电极(作负极)插入溶液,测定其电动势。然后将1.00mL0.0731mol·L-1的Ca2+标准溶液加入杯中后,测得电动势降低了13.6mV。计算水样中Ca2+的浓度(mol·L-1)。
25℃时,用pH=4.00的标准缓冲溶液,测得电池:“玻璃电极|H+(a=Xmol·L-1)‖饱和甘汞电极”的电动势为0.814V,那么在c(HAc)=1.00×10-3mol·L-1的醋酸溶液中,此电池的电动势为多少?(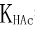 =1.8×10-5,设a(H+)=[H+])
=1.8×10-5,设a(H+)=[H+])
A.Hg|Hg2Cl2(1 mol·L-)| KCl(饱和);
B.Hg|Hg2Cl2(固)|KCl(饱和);
C.Hg|Hg2Cl2(固)| HCl(1 mol·L-1);
D.Hg|HgCl2(固)| KCl(饱和)。
用c[La(NO3)3]=0.03318mol·L-1La(NO3)3溶液滴定100·0mL0.03095mol·L-1的NaF溶液,滴定反应为:La3++3F-====LaF3↓。用固体LaF3膜电极为指示电极(正极),饱和甘汞电极为参比电极(负极),测得其滴定数据如下:
| V[La(NO3)3]/mL | 电池电动势E/V |
| 0.00 30.30 30.60 30.90 31.20 31.50 32.50 50.00 | -0.1046 0.0041 0.0179 0.0410 0.0656 0.0769 0.0888 0.1118 |

准确量取30.00 mL弱酸HA,加水稀释至100.00 mL,在电池:(—)SHE|HA || SCE()中,以0.100 0 mol·L-1NaOH标准溶液滴定之。25℃时,当弱酸HA被中和一半时,电池电动势为0.524 V,化学计量点时,电池电动势为0.749 V。求:(1)弱酸HA的电离常数Kα值。(2)原弱酸HA溶液的浓度?(已知饱和甘汞电极的电极电位为0.244 V)
设溶液中pBr=3,pCl=1,如用溴电极测定Br-活度,将产生多大的测量相对误差?相当于多少个pBr单位?(已知溴电极的选择性系数KBr-,cr-=0.006)