 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
用0.10mol·L-1NaOH溶液滴定0.10mol·L-1H3PO4至第一化学计量点,若终点pH值较化学计量点pH值高0.5单位。计算终
用0.10mol·L-1NaOH溶液滴定0.10mol·L-1H3PO4至第一化学计量点,若终点pH值较化学计量点pH值高0.5单位。计算终点误差。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
用0.10mol·L-1NaOH溶液滴定0.10mol·L-1H3PO4至第一化学计量点,若终点pH值较化学计量点pH值高0.5单位。计算终点误差。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“用0.10mol·L-1NaOH溶液滴定0.10mol·L-…”相关的问题
更多“用0.10mol·L-1NaOH溶液滴定0.10mol·L-…”相关的问题
用0.1000mol·L-1NaOH标准溶液滴定0.10mol·L-1HCl和0.10mol·L-1H3PO4混合溶液时,可能有______个滴定突跃。已知:H3PO4的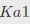 =7.5×10-3,
=7.5×10-3,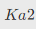 =6.2×10-8,
=6.2×10-8,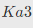 =2.2×10-13。
=2.2×10-13。
用0.10mol·L-1NaOH溶液滴定同浓度的HAc溶液时,若用甲基橙为指示剂(终点时pH=4.0),问终点时未被中和的HAc是多少?
用0.01mol/L EDTA滴定20.00mL0.01mol/L Ni2+,在pH=10的氨缓冲溶液中,使溶液中游离氨的浓度为0.10mol/L。计算lgK'NiY化学计量点时溶液中pNi'和pNi。
标定NaOH溶液浓度时,要求消耗0.10mol·L-1NaOH溶液体积为20mL,问:①应称取邻苯二甲酸氢钾基准物质(KHC8H4O4)多少克?②如果改用草酸(H2C2O4·2H2O)作基准物质,又该称取多少克?③若分析天平的称量误差为±0.0002g,试计算以上两种试剂称量的相对误差。④计算结果说明什么问题?
称取含NaH2PO4和Na2HPO4及中性杂质的试样1.000g,溶于适量水后,以百里酚酞作指示剂,用0.1000mol·L-1NaOH标准溶液滴定至刚好变色,耗去NaOH溶液20.00mL;继续于同一体系中加入溴甲酚绿指示剂(变色范围为pH=3.8~5.4),改用0.1000mol·L-1HCl标准溶液滴定至终点,耗去HCl溶液30.00mL,求试样中NaH2PO4、Na2HPO4的质量分数。[已知M(NaH2PO4)=120.0g·mol-1;M(Na2HPO4)=142.0g·mol-1]
面粉中粗蛋白质含量与氮含量的比例系数为5.7,2.449g面粉经消化后,用NaOH处理,将蒸发出的NH3用100.0mL0.01086mol·L-1HCl溶液吸收,然后用0.01228mol·L-1NaOH溶液滴定,耗去15.30mL。计算面粉中粗蛋白质的质量分数。
某KMnO4溶液在酸性介质中对Fe2+的滴定度
用0.10mol/L HCl标准溶液滴定0.10mol/L NaX(HX的Ka=5.0×10-10)。试问:能否准确滴定?并写出计算过程;若能准确滴定,计算化学计量点时的pH值?能用酚酞或甲基橙做指示剂吗?
准确量取30.00 mL弱酸HA,加水稀释至100.00 mL,在电池:(—)SHE|HA || SCE()中,以0.100 0 mol·L-1NaOH标准溶液滴定之。25℃时,当弱酸HA被中和一半时,电池电动势为0.524 V,化学计量点时,电池电动势为0.749 V。求:(1)弱酸HA的电离常数Kα值。(2)原弱酸HA溶液的浓度?(已知饱和甘汞电极的电极电位为0.244 V)
以铬黑T(EBT)为指示剂,在pH=10的NH3-NH4Cl缓冲溶液中,用0.02000mol/LEDTA滴定0.02000mol/L的Zn2+时,存在共存离子Ag+,其浓度是0.010mol/L。若在化学计量点时游离NH3的浓度为0.10mol/L:(1)能否准确滴定Zn2+? (2)计算该滴定的误差。
[lgKZnY=16.50;lgKAgY=7.32;pH=10时,lgKZn-EBT=12.2,lgαEBT(H)=1.6,lgαY(H)=0.45;Zn2+和Ag+的水解作用可忽略;银氨配合物的lgβ1=3.40、lgβ2=7.40;锌氨配合物的lgβ1=2.27、lgβ2=4.61、lgβ3=7.01、lgβ4=9.06]
A.0.68~1.51V
B.0.76~1.57V
C.0.96~1.37V
D.0.86~1.47V