 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
下列电极,标准电极电势最高的为:
A.Ag+/Ag;
B.AgCl/Ag;
C.AgBr/Ag;
D.AgI/Ag。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.Ag+/Ag;
B.AgCl/Ag;
C.AgBr/Ag;
D.AgI/Ag。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“下列电极,标准电极电势最高的为: A.Ag+/Ag; B.A…”相关的问题
更多“下列电极,标准电极电势最高的为: A.Ag+/Ag; B.A…”相关的问题
A.1.2 × 10-12 ;
B. 6.2 × 10-6 ;
C. 4.8 × 10-7 ;
D. 2.9 × 10-15
已知298.15K时,电极反应: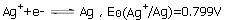 ,Ag2C2O4的Ksp为3.5×10-11,求电极反应Ag2C2O2+2e-
,Ag2C2O4的Ksp为3.5×10-11,求电极反应Ag2C2O2+2e- 2Ag+C2O2-4的标准电极电势
2Ag+C2O2-4的标准电极电势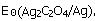 。
。
10.已知

的标准电极电势以及当
已知25℃时AgBr的溶度积Ksp=4.88×10-13,EΘ(Ag+/Ag)=0.7994V,EΘ(Br2/Br-)=1.065V,试计算25℃时:(1)银-溴化银电极的标准电极电势EΘ(AgBr(s)/Ag);(2)AgBr(S)的标准生成吉布斯函数。
电极反应




A.电动势的大小表明了电池反应的趋势
B.电动势的大小表征了原电池反应所做的最大非体积功
C.标准电动势小于零时,电池反应不能进行
D.标准平衡常数为1时,该电池反应达平衡
E.某些情况下电动势的值与电极电势值相同
已知下列标准电极电势
Cu2++2e-===Cu EΘ=0.337V
Cu2++e-===Cu+EΘ=0.153V
(1)计算反应Cu+Cu2+===2Cu+的平衡常数。
(2)已知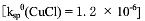 ,试计算下面反应的平衡常数。
,试计算下面反应的平衡常数。
Cu+Cu2++2Cl=2CuCl↓
将下列反应组成原电池(温度为298.15K):2Fe3++Cu====2Fe2++Cu2+
(1)计算原电池的标准电动势;(2)写出其电池符号;(3)指出正极、负极,并写出电极反应;(4)当Cu2+的浓度升到10mol·L-1时,原电池的电动势为多少?