 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
气态乙醛在518℃时的热分解反应如下 CH3CHo(g)→CH4(g)+C0(g) 此反应在密闭容器
气态乙醛在518℃时的热分解反应如下 CH3CHo(g)→CH4(g)+C0(g) 此反应在密闭容器中进行,初始压力为48.39kPa,压力增加值与时间的关系如下
1.jpg) 试求反应级数和速率系数(浓度以mol.dm-3为单位,时间以s为单位)。
试求反应级数和速率系数(浓度以mol.dm-3为单位,时间以s为单位)。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
气态乙醛在518℃时的热分解反应如下 CH3CHo(g)→CH4(g)+C0(g) 此反应在密闭容器中进行,初始压力为48.39kPa,压力增加值与时间的关系如下
1.jpg) 试求反应级数和速率系数(浓度以mol.dm-3为单位,时间以s为单位)。
试求反应级数和速率系数(浓度以mol.dm-3为单位,时间以s为单位)。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“气态乙醛在518℃时的热分解反应如下 CH3CHo(g)→C…”相关的问题
更多“气态乙醛在518℃时的热分解反应如下 CH3CHo(g)→C…”相关的问题
气态乙醛在791K时的热分解反应为:
CH3CHO→CH4+CO
在密闭真空容器中进行,充以初压为48.4kPa的气态乙醛,发生上述分解反应,已知压力增加值Δp与时间t的关系数据如下:求写出反应速率和有关化学方程式?
| t/s | 42.0 | 105 | 242 | 840 | 1440 |
| Δp/kPa | 4.53 | 9.86 | 17.86 | 32.53 | 37.86 |
变分子反应的计算比较
乙醛分解反应,反应式为
CH3CHO→CH4+CO
乙醛在520℃和0.1MPa大气压下以0.1kg/s流率进入理想管式反应器进行分解反应。已知在该反应条件下反应为不可逆二级反应,反应速率常数k=0.43×10-3m3/(mol·s)=0.43m3/(kmol·s)。试求进料乙醛分解35%的反应容积、空时和平均停留时间。
CH4气相热分解反应2CH4→C2H6+H2的反应机理及各基元反应的活化能如下:

已知该总反应的速率方程式为:
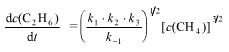
试求总反应的表观活化能。
乙醛的分解机理拟定如下:
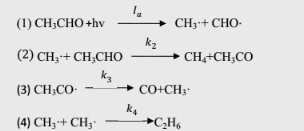 试推导出CO的生成速率表达式和CO的量子产率表达式。
试推导出CO的生成速率表达式和CO的量子产率表达式。
用波长为313nm的单色光照射气态丙酮,发生下列分解反应:
(CH3)2CO(g)+hν→C2H6(g)+CO(g)
若反应池的容量是0.059dm3,丙酮吸收入射光的分数为0.915,在反应过程中,得到下列数据:
反应温度840K 照射时间t=7.0h
起始压力102.16kPa 入射能48.1×10-4J·s-1
终了压力104.42kPa
计算此反应的量子效率。
气相反应的动力学参数
气相二甲醚分解反应可以通过间歇反应器的压力变化来研究。在504℃和41.59kPa的初压下得到如下数据:
t(s) | 390 | 777 | 1195 | 3155 | ∞ |
pt(kPa) | 54.39 | 65.05 | 74.91 | 103.84 | 124.10 |
起始时只有醚存在,其反应为
(CH3)2O→CH4+H2+CO
(A) (B) (C) (D)
试确定分解速率方程,并确定504℃时反应速率常数值。
N2O5的分解反应是2N2O5→4NO2+O2,由实验测得在67℃时N2O5的浓度随时间的变化如下:
 试计算: (1)在0~2.0 min内的平均反应速率:△c(O2)/△t=? (2)在第2.0 min时的瞬时速率:-dc(N2O5)/dt=? (3) N2O5浓度为1.00 mol.dm-3时的初速率:~dc(N2O5)/dt=?
试计算: (1)在0~2.0 min内的平均反应速率:△c(O2)/△t=? (2)在第2.0 min时的瞬时速率:-dc(N2O5)/dt=? (3) N2O5浓度为1.00 mol.dm-3时的初速率:~dc(N2O5)/dt=?
氧化乙烯的热分解反应为一级反应,已知在651K时,分解50%所需时间为363min,活化能Ea=217.6kJ·mol-1,试求如果在120min内分解75%,温度应控制在多少K?
N2O(g)的热分解反应2N2O(g)====2N2(g)+O2(g),在一定温度下,反应的半衰期与起始压力成反比。在970K时,N2O(g)的起始压力为39.2kPa,测得半衰期为1529s;在1030K时,N2O(g)的起始压力为48.0kPa,测得半衰期为212s。求:

双环戊烯单分子气相热分解反应,在483K时的速率常数k(483K)=2.05×10-4s-1,在545K时的速率常数k(545K)=1.86×10-2s-1。已知kB=1.38×10-23J·K-1,h=6.626×10-34J·s。
试计算:
(1)反应的活化能Ea
(2)反应在500K时的活化焓和活化熵
一氯乙酸在水溶液中进行分解,反应式如下:
ClCH2COOH+H2O→HOCH2COOH+HCl
今用λ=2537Å的光照射浓度为0.5mol/L的一氯乙酸样品1L,照射时间为t,样品吸收的能量ε及的实验结果如下:
| t/min | ε/J | c_{Cl^-}times 10^5/(mol/L) |
| 837 | 34.36 | 2.325 |
当用同样的样品在暗室中进行实验时,发现每分钟有3.5×10-10mol/L的Cl-生成。试计算该反应的量子效率Ф。