 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
试写出下列各电池的电极反应和电池反应。 (1)Cu(s)|CuSO4(a1)||AgNO3(a2)|Ag(s) (2)Pb(s)|PbSO4
试写出下列各电池的电极反应和电池反应。 (1)Cu(s)|CuSO4(a1)||AgNO3(a2)|Ag(s) (2)Pb(s)|PbSO4(s)|K2SO4(a1)||HCl(a2)|AgCl(s)|Ag(s) (3)Pt|H2(P)|NaOH(a)|HgO(s)|Hg(1) (4)Pt|H2(P1)|H2SO4(m)|H2(P2)|Pt (5)K(Hg)(a1)|K+(a2)||Cl-(a3)|Hg2Cl2(s)|Hg(1)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案


 更多“试写出下列各电池的电极反应和电池反应。 (1)Cu(s)|C…”相关的问题
更多“试写出下列各电池的电极反应和电池反应。 (1)Cu(s)|C…”相关的问题
 ,
, ,标准态时:(1)写出原电池符号(应自发进行);(2)写出电极反应及电池反应;(3)计算原电池的
,标准态时:(1)写出原电池符号(应自发进行);(2)写出电极反应及电池反应;(3)计算原电池的 ;(4)计算电池反应的
;(4)计算电池反应的 ;(5)求AgI的Ksp。
;(5)求AgI的Ksp。
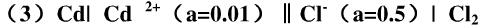
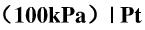
 当缓冲溶液由未知溶液代替时,测得电池电动势如下: (1)0.312V; (2)0.098V;(3)=0.017V。试计算每种溶液的pH值。
当缓冲溶液由未知溶液代替时,测得电池电动势如下: (1)0.312V; (2)0.098V;(3)=0.017V。试计算每种溶液的pH值。
















